5.
Sử dụng đồng vị lưu huỳnh
Có 4 đồng vị bền của S với tỉ lệ như sau:
32S = 95,02 %; 33S
= 0,75 %; 34S = 4,21 % và 36S = 0,02 %
Tỉ lệ giữa hai
đồng vị phổ biến nhất S34/S32 được tính toán tương tự như
đối với đồng vị oxy, nhưng ở đây chuẩn so sánh là Troilit (FeS) trong thiên
thạch sắt Canion Diablo (CDT).
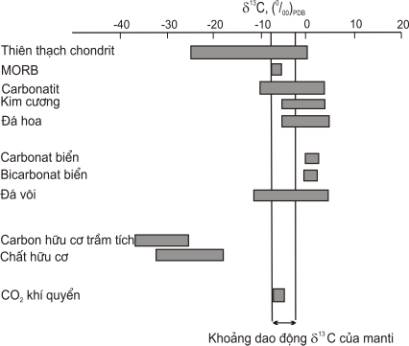
Hình 6.5. Biến thiên d13C trong các kiểu đá và nước
khác nhau (theo Rollison, 1995)
Những thực thể
chứa lưu huỳnh thường gặp trong tự nhiên bao gồm các khoáng vật sulphat và
sulphid, lưu huỳnh tự nhiên, khí H2S và SO2, và nhiều các
ion lưu huỳnh bị oxy hoá và khử trong các dung dịch. Biến thiên tỉ lệ đồng vị
lưu huỳnh của các kiểu đá và nước chủ yếu được trình bày ở Hình 6.6.
Có 3 miền nguồn
đồng vị riêng biệt của d34S: 1) lưu huỳnh nguồn manti
với giá trị d34S trong khoảng 0±3 ‰; 2) lưu huỳnh nước biển với giá trị d34S hiện tại khoảng
+20 ‰, mặc dù giá trị này đã thay đổi trong quá khứ, và 3) lưu huỳnh bị khử
mạnh (lưu huỳnh trầm tích) với giá trị d34S âm.
Thành phần đồng
vị d34S của manti nguyên thủy so
với chuẩn (CDT) là +0,5 ‰, nhưng khác biệt chút ít so với thành phần đồng vị
của thiên thạch chondrit (+0,2 ± 0,2 ‰). Các giá trị d34S của MORB đặc trưng cho
nguồn manti nghèo (DM) biến thiên trong giới hạn hẹp d34S = +0,3 ± 0,5 ‰. Các đá núi lửa cung đảo (IAB) có giá
trị d34S thay đổi lớn hơn (từ -0,2
đến 20,7 ‰). Thành phần đồng vị d34S của granit cũng thay đổi
nhiều, từ -10 đến 15 ‰ và thể hiện sự biến thiên rộng so với giá trị trung bình
của vỏ lục địa (d34S =
+7,0 ‰).
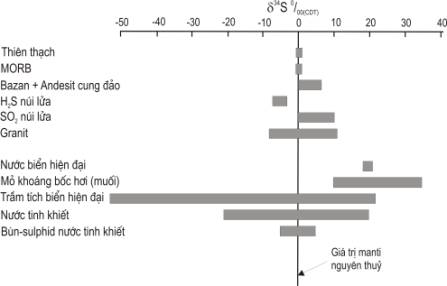
Hình 6.6. Biến thiên d34S trong các kiểu đá và nước
khác nhau (theo Rollinson, 1995)
Giá trị d34S của nước biển hiện đại
biến thiên trong khoảng 18,5 và 21,0 ‰. Các mỏ sulphat bốc hơi hiện tại giàu d34S hơn nước biển (khoảng 1-2 ‰), mối tương quan này được tận dụng để xác
định giá trị d34S của nước biển cổ.
Sự phân dị đồng
vị lưu huỳnh trong dung thể magma là không đáng kể cả trong magma felsic và
mafic.
Quá trình phân
dị thể hiện rõ rệt ở sự khử khí SO2 trong các dung nham dưới biển
nông. Quá trình phân dị này bị tỉ lệ sulphat/sulphid trong dung thể kiểm soát,
và dung thể chịu sự chi phối của nhiệt độ, áp suất, hàm lượng nước và hoạt tính
oxy.
Phân dị đồng vị
lưu huỳnh trong các quá trình nhiệt dịch xảy ra theo các sơ đồ khác nhau với
điều kiện nhiệt độ cao và thấp.
Trong điều kiện nhiệt độ cao (> 400oC),
các pha chứa lưu huỳnh chủ yếu là H2S và SO2, còn thành
phần đồng vị của chất lưu được xác định theo công thức sau:
d34Sch.lưu = d34SH2S XH2S
+ d34SSO2XSO2
ở đây XH2S - phần phân tử H2S so với tổng lưu
huỳnh trong chất lưu; XSO2- phần phân tử SO2. Hệ số phân
dị tương đối cao và được đưa ra trong Bảng 6.1 cho các khoáng vật khác nhau,
còn sự phụ thuộc của các hệ số phân dị vào nhiệt độ thể hiện trên Hình 6.7.
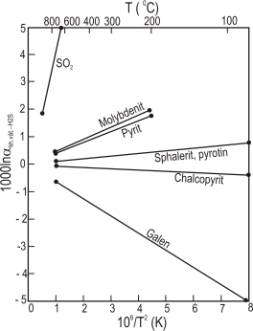
Hình 6.7. Biểu đồ
minh hoạ sự phân bố của 34S giữa các khoáng vật và H2S
như là hàm nhiệt độ
Ở nhiệt độ thấp (< 350oC), pha
chứa lưu huỳnh chủ yếu là sulphat và H2S. Các tài liệu về các
sulphat quan trọng nhất được dẫn ra ở Bảng 6.1. Sự phân dị d34S giữa các pha chứa lưu
huỳnh khác nhau trong nhiệt dịch không phải là hàm nhiệt độ đơn giản. Nói cụ
thể hơn nó được xác định bởi các điều kiện hoá lý của chất lưu, mà chất lưu lại
phụ thuộc vào hoạt tính của oxy, lưu huỳnh, pH và các cation đi cùng với
sulphat.
Việc sử dụng các tỉ lệ đồng vị của lưu huỳnh
trong thạch luận các đá magma nhằm nghiên cứu các vấn đề sau:
Bảng 6.1. Phân bố 34S giữa H2S và pha
sulphid. Tính theo phương trình 1000lnakh.vật-H2S = A(106/T2)
+ B (nhiệt độ Kelvin) (Rollinson, 1995)
|
Khoáng vật |
A |
B |
Khoảng nhiệt độ (oC) |
|
Anhydrit
/ thạch cao |
6,463 |
0,56 ± 0,5 |
200 - 400 |
|
Barit |
6,5 ± 0,3 |
|
200 - 400 |
|
Molybdenit |
0,45 ± 0,1 |
|
Chưa xác định |
|
Pyrit |
0,40 ± 0,08 |
|
200 - 700 |
|
Sphalerit |
0,10 ± 0,05 |
|
50 - 705 |
|
Pyrotin |
0,10 ± 0.05 |
|
50 - 705 |
|
Chancopyrit |
-0,05 ± 0,08 |
|
200 - 600 |
|
Bismuthin |
-0,67 ± 0,07 |
|
250 - 600 |
|
Galen |
-0,63 ± 0,05 |
|
50 - 700 |
|
SO2 |
4,70 |
-0,50 ± 0,5 |
350 - 1050 |
a) Sự thoát
khí SO2.
Ví dụ nghiên cứu các đá bazan dưới biển và trên cạn của núi lửa Kilauea
đã chỉ ra quá trình thoát khí nhanh gây nên biến đổi tỉ lệ đồng vị của lưu
huỳnh.
b) Sự hỗn
nhiễm. Nghiên
cứu tổ hợp đá bazan-andesit-dacit của cung đảo Mariana có các giá trị d34S trong khoảng +2 đến +20,7
‰. Dãy giá trị này quá lớn so với các giá trị của manti, phản ánh sự hỗn nhiễm
với sulphat của nước biển có d34S = +20 ‰.
c) Phân đoạn
kết tinh.
Một số khối gabro phân lớp chứa các lớp giàu sulphid có nguồn gốc magma. Ví dụ
đối với khối Huntley-Knock ở Scotland giá trị d34S trong sulphid khoảng 0,5
‰, rất gần với manti (Fletcher et al., 1989). Trong khi đó trong chính
đá magma thực sự trị số d34S lại thay đổi rõ rệt từ đới
tiếp xúc (có giá trị -1,2 ‰) tới các đá tích tụ và hạt lớn (khoảng +2,4 ‰). Sự
thay đổi này được quan niệm do sự phân đoạn đồng vị magma trong điều kiện hoạt
tính oxy thay đổi.
Một vấn đề rất quan trọng là sử dụng đồng vị lưu huỳnh để
làm sáng tỏ nguồn gốc của các thành tạo quặng nhiệt dịch. Các nghiên cứu
nhằm mục đích: xác định nguồn gốc của các khoáng vật sulphur (sulphid và
sulphat) trong các thân quặng; xác định nhiệt độ thành tạo của các sulphid và
dung dịch tạo quặng; xác định ảnh hưởng của tỉ số nước/đá trong quá trình tạo
khoáng; xác định mức độ cân bằng đạt được; các cơ chế lắng đọng quặng.
Những vùng
nhiệt dịch nhiệt độ cao đang hoạt động tại các dãy núi giữa đại dương tạo cơ
hội tốt nhất để nghiên cứu mỏ khoáng nhiệt dịch. Mô hình hiện tại quan niệm
rằng sulphat nước biển lạnh di chuyển xuống phía dưới đi vào trong các bazan
đáy đại dương, ở đó bị nóng lên khi cận kề lò magma. Một số sulphat kết tủa
dưới dạng anhydrit, trong khi phần còn lại biến đổi thành sulphid, do tác dụng
với bazan. Chất lưu thoát ra trên bề mặt đáy đại dương ở nhiệt độ khoảng 350oC
cùng với các sulphid. Trong quá trình hòa trộn với nước biển chúng bị kết tủa
trên bề mặt đáy biển dưới dạng trầm tích sulphid mịn, trong khi đó tại ống núi
lửa bản thân các sulphid tạo nên "ống khói" cao.
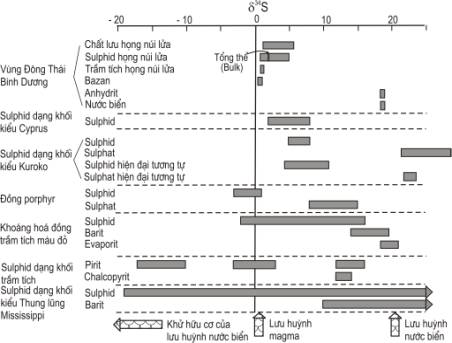
Hình 6.8. Giá trị d34S của các khoáng vật chứa
lưu huỳnh trong các mỏ khoáng nhiệt dịch (theo Rollinson, 1995)
Thành phần đồng
vị lưu huỳnh của các thành tạo mỏ khoáng nhiệt dịch đã được Ohmoto (1986)
nghiên cứu. Các giá trị d34S của các mỏ khoáng nhiệt
dịch được tổng hợp trên Hình 6.8. Từ đây có thể thấy rằng, một số kiểu mỏ
khoáng có dãy thành phần hẹp và bởi vậy chúng có nguồn gốc khá đặc trưng, trong
khi đó các kiểu mỏ khoáng khác lại có thành phần đồng vị biến đổi rộng và có
nguồn gốc khá phức tạp.