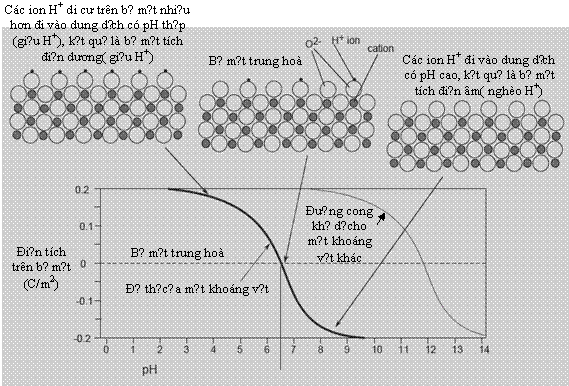
H́nh 1. Một
cách giải thích điểm điện tích không (PZC) của
Railsback [14],
ví dụ với một khoáng vật có pHPZC = 6,6
KẾT
QUẢ BƯỚC ĐẦU XÁC ĐỊNH ĐIỂM ĐIỆN
TÍCH KHÔNG CỦA BAZAN PHƯỚC LONG, TÂY NGUYÊN
BẰNG PHƯƠNG PHÁP ĐO pH
NGUYỄN
TRUNG MINH1, NGUYỄN ĐỨC CHUY2, NGUYỄN
THU HOÀ2, LÊ QUỐC KHUÊ2,
CÙ SỸ THẮNG1,
NGUYỄN THỊ THU1, NGUYỄN KIM THƯỜNG1,
NGUYỄN TRUNG KIÊN1,
ĐOÀN THỊ THU TRÀ1, PHẠM TÍCH XUÂN1,
CÙ HOÀI NAM3
1Viện Địa chất - Viện KH&CN
VN, Ngơ 84, Phố Chùa Láng, Hà Nội; 2Khoa Hoá - Trường
Đại học Sư phạm Hà Nội, Cầu Giấy,
Hà Nội; 3Chi cục Bảo vệ Môi trường
khu vực miền Trung và Tây Nguyên
Tóm tắt: Khai thác quặng bauxit và xử lư ô
nhiễm sau khai thác là một vấn đề thời sự
và cấp bách đối với nước ta. Xử
lư ô nhiễm môi trường bằng phương pháp hấp
phụ là một trong số các công nghệ xử lư nước
thải tinh (sau công đoạn xử lư thô) hiện nay, có
hiệu quả và phù hợp, nước sau xử lư đạt
tiêu chuẩn chất lượng nước được
phép thải ra môi trường.
Đối
với các nguyên liệu khoáng và vật liệu dùng làm chất
hấp phụ ion kim loại nặng, ngoài các thông số vật
lư cần xác định c̣n cần đến một thông số
thực nghiệm quan trọng nữa là điểm điện
tích không (PZC), đôi khi c̣n được gọi là điểm
đẳng điện pI (izoelectric point). Trong khuôn khổ
bài viết này, chúng tôi tŕnh bày kết quả thí nghiệm
xác định PZC của bazan Phước Long, Tây Nguyên bằng
phương pháp hoá học (đo pH).
Phương
pháp hoá học xác định điểm PZC của bazan
Phước Long bằng dung dịch muối KCl, KNO3,
NaCl và NaNO3, ở hai nồng độ 0,1 M và 0,01 M
cho kết quả: PZC của đá bazan nằm dao động
trong khoảng 6,61 - 6,70 và không phụ thuộc nồng độ
của chất điện ly cũng như loại muối;
giá trị pHPZC dao động trong khoảng nhỏ
±0,03, giới hạn sai số của máy đo.
I. MỞ ĐẦU
Vấn đề ô nhiễm môi trường
ngày càng trở nên phổ biến và trầm trọng trên thế
giới cũng như ở nước ta. Vấn đề
chất thải của các ngành công nghiệp, khai thác, chế
biến quặng nói chung và đặc biệt là bauxit
đang là sự quan tâm hàng đầu của Đảng,
Chính phủ và nhân dân ta, v́ vậy vấn đề xử
lư chất thải, nước thải trước khi thải
ra môi trường cần được nghiên cứu và
đưa vào ứng dụng.
Tốc độ công nghiệp hoá, hiện
đại hoá và sự gia tăng dân số đă đưa
đến sự khai thác ngày càng triệt để nguồn
tài nguyên của Trái đất, đồng thời làm ô nhiễm
môi trường, đặc biệt là ô nhiễm nguồn
nước bởi những chất thải có hàm lượng
kim loại nặng cao. Loại chất thải này có độc
tính lớn, ảnh hưởng nghiêm trọng đến
đời sống của động vật, thực vật
nói chung và con người nói riêng. Các kim loại nặng (Cu,
Pb, Zn, Cd, As) phân bố trong hầu hết bề mặt Trái
đất. Chúng sinh ra trong quá tŕnh vận động của
Trái đất, trong hoạt động sản xuất của
con người, tích tụ trong đất, trong nước,
trong bụi của không khí, trong cơ thể của một
số sinh vật... Khi nhiễm vào cơ thể con người,
các kim loại nặng tích luỹ phần lớn trong
xương, năo, thận, cơ bắp thịt và gây ra những
tác động như rối loạn thần kinh, thiếu
máu, ... nặng hơn nữa là căn bệnh ung thư.
Xử lư ô nhiễm môi trường bằng
phương pháp hấp phụ là một trong số các công
nghệ xử lư nước thải sau công đoạn xử
lư thô hiện nay, có hiệu quả và phù hợp; nước
sau xử lư đạt tiêu chuẩn chất lượng
nước được phép thải ra môi trường.
Vấn đề
xử lư kim loại nặng trong chất thải nhằm hạn
chế đến mức thấp nhất tác hại của
chúng đến môi trường là vấn đề cấp
thiết mang tính toàn cầu. Việc nghiên cứu t́m kiếm
nguồn vật liệu giá rẻ, có nguồn gốc tự
nhiên như than bùn, kaolin, carbon hữu cơ, ... đặc
biệt là các
loại đá, để xử lư môi trường là lĩnh
vực hoàn toàn mới mẻ ở Việt Nam cũng
như trên thế giới, nhưng bước đầu
đă mang lại những kết quả khả quan.
1. Điểm
điện tích không
Việc
xử lư ô nhiễm kim loại nặng trong nước thải
bằng các vật liệu giá rẻ và hiệu quả là việc
làm không những có ư nghĩa kinh tế mà c̣n có cả ư nghĩa
khoa học.
Ở các nước châu Âu, các vật
liệu đó thường là các zeolit tự nhiên như
clinoptilolit, chabazit, ... Ở các nước châu Á, do có điều
kiện địa chất khác, các vật liệu zeolit tự
nhiên thường hiếm, v́ vậy việc sử dụng
các nguyên liệu khác như đá ong, bazan, sét, ... để
tạo ra zeolit là cần thiết.
Với các nguyên liệu khoáng dùng làm
chất hấp phụ ion kim loại nặng, ngoài các thông số
cần xác định như: dung lượng hấp phụ,
năng lượng hoạt hoá, thời gian nửa phản
ứng, bậc phản ứng, ... c̣n cần xác định
một thông số thực nghiệm quan trọng là điểm
điện tích không (Point of zero charge - PZC), đôi khi c̣n được gọi
là điểm đẳng điện (Izoelectric point - Ip).
2. Khái niệm
Trong hoá lư, điểm điện
tích không PZC là một khái niệm về hiện tượng
hấp phụ, cho biết điều kiện khi mật
độ điện tích trên bề mặt bằng 0.
Thường PZC được xác định ở pH của chất điện ly và
gán cho chất nền hay hạt keo.
Giá trị
pH được dùng để mô tả PZC chỉ áp dụng
cho hệ H+/
Trong khoa
học về bề mặt, PZC là một cơ sở quan
trọng, ví dụ trong lĩnh vực khoa học môi trường,
PZC xác định được chất nền dễ dàng
hấp phụ các ion có hại.
Sau đây là một cách giải thích
PZC của Railsback [14]: “ Điểm điện tích 0” đối
với một bề mặt khoáng vật là pH tại đó
bề mặt nói trên có điện tích trung hoà toàn phần.
3. Ư nghĩa của
đồ thị (H́nh 1)
Bề mặt của khoáng vật có
điện tích dương ở giá trị pH nhỏ
hơn pHPZC th́ bề mặt đó có thể hấp
phụ anion. Mặt khác, bề mặt khoáng vật có điện
tích âm ở giá trị pH lớn hơn pHPZC th́ bề
mặt có thể hấp phụ cation.
Một vật liệu là tập hợp
của các khoáng vật khác nhau, v́ vậy điểm PZC của
vật liệu đó là kết quả đo tổng hợp
của cả hỗn hợp đó. Kết quả này chỉ
có thể biết được bằng phương pháp
đo thực nghiệm.
Khái niệm điểm
điện tích không PZC được đưa ra vào những
năm 1950 khi nghiên cứu sự kết bông của các hạt
keo trong nước [1, 7, 13]. Trong những năm 60, 70 của
thế kỷ XX, trong điện hoá học có nhiều
phương pháp đo PZC của các kim loại, trong đó
có phương pháp sung nung sơ bộ [16] cho kết quả phù hợp với
nhiều phương pháp khác được đo bằng
volt (xem Bảng 1).

H́nh 1. Một
cách giải thích điểm điện tích không (PZC) của
Railsback [14],
ví dụ với một khoáng vật có pHPZC = 6,6
Trong điện hoá học, giữa bề
mặt điện cực và chất điện ly có điện
tích. Nếu điện cực bị phân cực th́ bề
mặt của nó phụ thuộc vào thế điện cực,
PZC ở các bề mặt này (tính theo von: V) được
dùng để xác định thế điện cực tuyệt
đối của chất điện ly ấy.
Bảng
1. Một số kết quả xác định PZC của
một số kim loại đo bằng volt [16]
|
Kim loại |
PZC (V) |
|
Cd |
-0,74 |
|
Pb |
-0,57 |
|
Bi |
-0,42 |
|
Sn |
-0,52 |
|
Ag |
-0,66 |
|
Hg |
-0,90 |
Cuối
thế kỷ XX - đầu thế kỷ XXI, thế giới
phải đối đầu với vấn đề ô
nhiễm môi trường. Các nhà khoa học quan tâm đến
vấn đề xử lư ô nhiễm ion kim loại nặng
trong nước thải bởi các oxit kim loại. Việc
xác định được PZC của các oxit kim loại
tổng hợp và trong khoáng vật tự nhiên trở nên rất
quan trọng.
Trên thế giới hiện nay tồn tại
4 nhóm phương pháp chính có thể xác định
được điểm điện tích không PZC của vật
liệu, gồm: PT: Potentionmetric titration (Van Raij & Peech,
1972), RPT:
Rapid potentionmetric titration (Laverdier & Weaver,
1977), ST:
Salt titration (Uehara & Gilman, 1980; Backers et
al., 1995), ST-PT (Sakurai et al, 1988, He et al., 1995),
trong đó có một số phương pháp biến thể
chi tiết: CIP Intersection, pH, IEP, Acousto [3-6]. Tuỳ thuộc
vào nguồn oxit kim loại, dung dịch chất điện
ly và phương pháp đo mà giá trị pHPZC của
chúng có những giá trị khác nhau.
Bảng
2. Kết quả đo pHPZC của một số
oxit kim loại và khoáng vật [3-6]
|
Khoáng vật |
Chất
điện ly |
Phương pháp |
pHPZC |
|
Fe2O3 |
NaNO3 0,1 M |
pH |
6,5 |
|
IEP |
6,2 |
||
|
Cr2O3 |
NaCl 0,01 M |
pH |
5,4 |
|
Cr(OH)3 |
KNO3 0,002
M |
IEP |
8,6 |
|
Cr(OH)3 |
KCL 0,01 M và 0,0001 M |
IEP |
8,5 |
|
Kaolinit |
NaNO3 0,1 M
và 0,01 M |
pH |
5,5 – 6,0 |
|
Kaolinit |
|
IEP |
< 2,4 |
|
Ca5(PO4)3F |
NaNO3 0,1M |
IEP |
< 6 |
|
pH |
5,7 |
||
|
Zeolit tự nhiên |
|
|
< 2 |
|
Carbon hoạt tính |
|
|
7,5- 9,5 |
|
Thuỷ tinh |
|
|
2,5- 5 |
|
Bauxit |
|
|
6-7,8 |
II. ĐỐI TƯỢNG VÀ PHƯƠNG
PHÁP NGHIÊN CỨU
Bazan
Kainozoi muộn ở Việt Nam phân bố rải rác từ
bắc đến nam và nhiều vùng thuộc Biển
Đông, nhưng tập trung chủ yếu trên cao nguyên Nam
Trung Bộ. Chúng là một bộ phận cấu thành của
bazan Kainozoi Đông Nam Á, tạo thành các lớp phủ có diện
tích rất khác nhau, từ một vài km2 như ở Lũng Pô Hồ,
Điện Biên Phủ đến hàng ngh́n km2 ở
Phước Long, Pleiku, Buôn Ma Thuột, v.v... (H́nh 2). Tổng
diện tích lớp phủ bazan ước tính trên 25.000 km2
với bề dày thay đổi từ 1-2 đến 500 m.
Có thể mô tả chúng theo các vùng phân bố như sau (H́nh 2): 1. Khu vực Bắc Bộ; 2. Khu vực Bắc Trung Bộ; 3.
Khu vực Nam Trung Bộ [10, 11, 12].
Trong
khuôn khổ bài báo này, chúng tôi đề cập đến
nhóm bazan Phước Long. Đây là vùng bazan lớn nhất,
trải rộng trên địa phận các tỉnh Đồng
Nai, B́nh Phước, B́nh Dương, Tây Ninh, Đắc
Nông, Đăk Mil (Đắc Lắc) và gắn liền với
vùng bazan Campuchia. Tổng diện tích lớp phủ bazan
đạt >6.000 km2. Bazan có dạng ḍng chảy với
chiều dày thay đổi, có nơi đạt >200 m (lỗ
khoan 804). Tổng thể tích bazan của nhóm này ước
tính trên 2.200 km3. Thành phần chủ yếu là
tholeiit, ít hơn có tholeiit olivin, đôi khi là hawaiit. Tuổi
đồng vị của bazan Phước Long nằm trong
khoảng 9,1 - 4,6 Tr.n. và thuộc Miocen muộn - Pliocen sớm.
Kết
quả phân tích thành phần bazan Phước Long bằng
phương pháp XRF (Bảng 3) cho thấy đây là bazan giàu
nhôm (bauxit), có giá trị công nghiệp luyện nhôm.
Bảng
3. Thành phần
nguyên tố của
bazan Phước Long theo phương pháp XRF
|
Nguyên tố |
(%) |
Nguyên tố |
(%) |
|
Al |
21,1872 |
Cr |
0,0302 |
|
Fe |
11,4299 |
Mn |
0,0828 |
|
Si |
1,0603 |
Zr |
0,0178 |
|
V |
0,0203 |
Ti |
1,3229 |
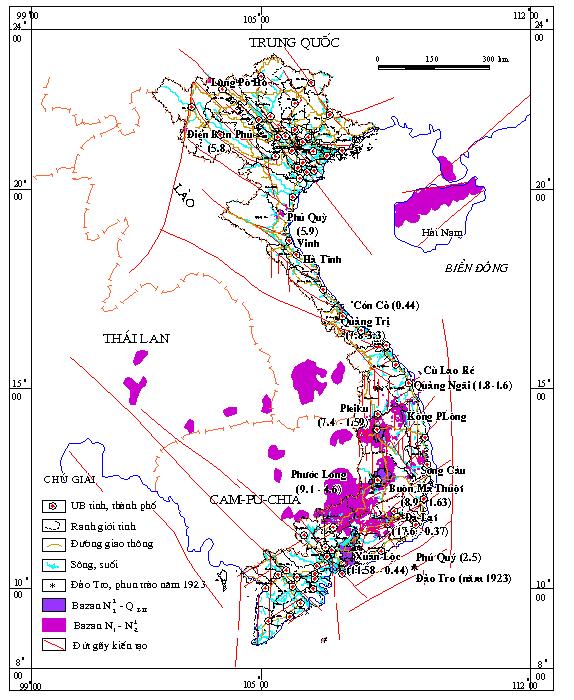
H́nh 2. Sơ
đồ phân bố bazan Kainozoi muộn Việt
(các số trong ngoặc là tuổi
của bazan) [10, 11, 12].
Bazan
Phước Long chủ yếu là tholeiit (tới 90%), ít
hơn có tholeiit olivin, đôi khi gặp hawaiit. Đá thường
có cấu tạo đặc xít, đôi khi là lỗ rỗng.
Các ḍng bazan ở nhiều nơi có cấu tạo dạng cột
rất điển h́nh. Tholeiit có kiến trúc porphyr yếu với
lượng ban tinh <7%, chủ yếu là plagioclas. Plagioclas
đạt kích thước tới 1,5 mm. Ban tinh clinopyroxen và
olivin chỉ gặp trong tholeiit olivin ở phần trên của
mặt cắt. Nền gồm plagioclas - 70%, clinopyroxen - 20%,
thủy tinh núi lửa - 10%, magnetit, kiến trúc microdolerit hoặc
intersertan.
III. THỰC
NGHIỆM: CÁC THÍ NGHIỆM XÁC ĐỊNH ĐIỂM ĐIỆN
TÍCH KHÔNG
Thí nghiệm xác định điểm
điện tích không của bazan Phước Long, Tây Nguyên
trong dung dịch muối NaCl, KCl, KNO3 và NaNO3
bằng máy đo pH: microprocessor pH/Ion Meter pMX3000 (CHLB Đức)
với độ chính xác bằng ±0,03.
1. Xác định
pHPZC của bazan Phước Long, Tây Nguyên trong dung dịch
muối KCl
Điều kiện thí nghiệm:
- Nhiệt độ không khí: 29,6°C
- Nhiệt độ dung dịch: 27,8°C - 28,5°C
- Độ ẩm: 85%
- Lấy vào ống đong 25 ml dung dịch
KCl 0,1M đă pha, điều chỉnh giá trị pH bằng
dung dịch HCl 0,1M hoặc dung dịch NaOH 0,1M để
được các giá trị pHi: 2, 4, 6, 7, 8, 10 và 12.
Đổ các dung dịch đă chuẩn
pHi ở trên vào các b́nh tam giác đă chứa chất
hấp phụ là đá bazan (0,5 gam bazan), đậy kín, cho
lên máy lắc trong 48 giờ. Để lắng, lọc sạch
huyền phù bằng giấy lọc, đo lại các giá trị
pH gọi là pHf: DpH
= pHf - pHi.
- Làm
tương tự với dung dịch KCl 0,01M ta có 7 lọ
dung dịch KCl 0,01M với pHi tương ứng 2,
4, 6, 7, 8, 10, 12.
a.
Thí nghiệm xác định sơ bộ điểm điện
tích không: Hệ số tương
quan R2 = 0,984 với cả hai đường cong và
sự trùng nhau ở điểm cắt trục hoành của
hai đường cong cho thấy sự phù hợp tốt
giữa thực nghiệm và lư thuyết. Kết quả xác
định sơ bộ trên cho phép dự đoán điểm
điện tích không của đá bazan Phước Long trong
khoảng 6,50-7,0. Để có kết quả chính xác hơn,
chúng tôi đă tiếp tục tiến hành xác định
chính xác điểm điện tích không bằng cách chia nhỏ
khoảng cách pHi như sau: 6,2, 6,4, 6,6, 6,8 và 7,0.
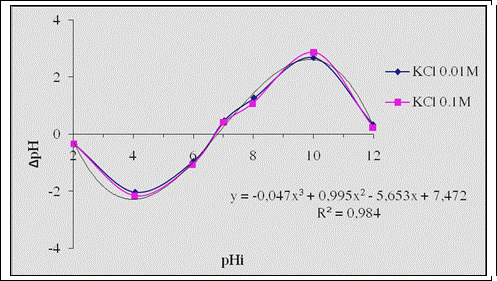
H́nh 3. Xác định sơ bộ
điểm điện tích không của bazan Phước
Long
trong dung dịch KCl 0,01M và 0,1M

H́nh 4. Xác định
chính xác điểm điện tích không của bazan Phước
Long
trong dung dịch KCl 0,01M và 0,1M.
b. Thí nghiệm xác định chính
xác điểm điện tích không: Nồng độ
KCl 0,1M trên đồ thị biểu diễn sự phụ
thuộc ΔpH vào pHi là
đường y = 0,887x - 5,833 với hệ số
tương quan R2 = 0,977 cho thấy sự phù hợp
tốt giữa thực nghiệm và lư thuyết (đường
bậc 1). Với nồng độ KCl 0,01M, đồ thị
biểu diễn sự phụ thuộc ΔpH vào pHi là
đường y = 0,926x - 6,085 với hệ số
tương quan R2 = 0,971 cho thấy sự phù hợp
tương đối tốt giữa thực nghiệm và
lư thuyết.
Điểm
điện tích không của bazan Phước Long xác định
trong dung dịch KCl là pH = 6,61 - 6,62 (điểm
có ΔpH = -0,01).
Tương
tự cách làm trên với cả 4 loại muối ta thu
được kết quả sau (Bảng 4):
Bảng 4. Kết quả
xác định pHPZC của bazan Phước Long với
4 loại muối
|
|
KCl |
KNO3 |
NaNO3 |
NaCl |
||||
|
0,1M |
0,01 M |
0,1 M |
0,01 M |
0,1 M |
0,01 M |
0,1 M |
0,01 M |
|
|
Giá trị PZC |
6,62 |
6,61 |
6,68 |
6,65 |
6,70 |
6,69 |
6,68 |
6,67 |
Như vậy, ta kết
luận xác định pHPZC của bazan Phước
Long với cùng một loại muối không
phụ thuộc vào nồng độ của muối
đó.
Giá trị pHPZC
của bazan Phước Long với các muối khác nhau
cũng cho kết quả chênh lệch rất ít. Cụ thể
kết quả chênh lệch nhiều nhất cũng chỉ
là 6,70 - 6,61 = 0,09. Kết quả này là chấp nhận
được trong sự cho phép sai số phép đo pHPZC.
Vậy điểm điện tích không pHPZC của
bazan Phước Long cũng không phụ thuộc vào loại
muối được làm thí nghiệm và có giá trị pHPZC
= 6,61 - 6,70.
KẾT LUẬN
Sử dụng phương pháp hoá học
xác định điểm điện tích không của bazan
Phước Long, Tây Nguyên trong dung dịch muối KCl, KNO3,
NaCl và NaNO3 ở hai nồng độ khác nhau cho kết
quả chính xác gần như nhau:
- Giá trị điểm điện tích
không pHPZC của bazan Phước Long, Tây Nguyên là
6,61 - 6,70.
- Kết quả xác định
PZC của bazan Phước Long trên gợi ra cho chúng ta một
phương pháp đơn giản, chính xác để xác
định PZC cho các vật liệu khác trong điều kiện
Việt Nam khi chưa có nhiều máy đo tự động
thế Zeta, điểm pHPZC (Máy đo thế zeta
này được mua năm 2009 và đặt tại Viện
Địa chất, Viện KH&CN VN trong khuôn khổ đề
tài KC.02.25/06-10).
Từ các kết quả thu được
trên, chúng tôi hy vọng phát triển phương pháp xác định
PZC trên đây cho các vật liệu khác. Chúng tôi sẽ tiếp
tục hoàn thiện kỹ thuật chế tạo hạt vật
liệu từ nguyên liệu khoáng tự nhiên, phục vụ
mục đích xử lư nước thải môi trường
bị ô nhiễm kim loại nặng.
Bài báo này được hoàn thành trong
khuôn khổ Đề tài KHCN trọng điểm cấp
Nhà nước KC.02.25/06-10. Các tác giả xin chân thành cảm
ơn bộ Khoa học và Công nghệ, Văn pḥng các
Chương tŕnh trọng điểm cấp Nhà nước
và Chương tŕnh KC.02 giai đoạn 2006-2010.
VĂN
LIỆU
1.
Babcock K.L., Overstreet R., 1953. On the use of half calomel cells in measure
Donnan potentials. Science, 117 : 686-687.
2.
Ho Yuh-Shan, 2006.
Isotherms for the absorption of lead onto peat: Comparison of linear and
non-linear methods. Polish J. of Envir. Stud., 15/1 : 81-86. Warsawa.
3.
Kosmulski M., 2002.
The pH - Dependent surface science charging and the point of zero charge. J.
of Colloid and Interface Sci., 253 : 77-87.
4.
Kosmulski M., 2004.
The pH - Dependent surface science charging and the point of zero charge. II
update. J. of Colloid and Interface Sci., 275 : 214-224.
5.
Kosmulski M., 2004.
Chemical properties of material surfaces.
6.
Kosmulski M., 2006.
The pH - dependent surface science charging and the point of zero charge. III
update. J. of Colloid and Interface Sci., 298 : 730-741.
7.
Kruyt H.R., 1952.
Colloid science. Vol. Irreversible systems. Elsevier,
8.
Kwon Jang Soon, 2003.
Geochemical investigation of the removal of aqueous heavy metals (Pb, Zn, Cu,
Cd) by scoria from
9. Nguyễn Đức Chuy,
Nguyễn Trung Minh, Nguyễn Việt Khoa, Nguyễn Thị
Phương Lan, 2008. Bước đầu
nghiên cứu sự hấp phụ ion Pb2+ của
đá bazan Phước Long, Việt Nam. TC Khoa học,
ĐHSP Hà Nội, 53/1 : 126-134. Hà Nội.
10. Nguyễn Xuân Hăn, Nguyễn Trọng
Yêm, Nguyễn Hoàng, Cung Thượng Chí, Phạm Tích Xuân,
1991. Hoạt động núi lửa
Kainozoi muộn ở Nam Trung Bộ. Địa chất,
202-203 : 33-41. Hà Nội.
11.
Overbeek J., Th.G. Donnan, 1953. EMF and suspension effects. J. Colloid
Science, 8 : 593-605.
12. Phạm Tích Xuân, Nguyễn Trọng
Yêm, 1999. Đặc điểm hoạt
động núi lửa Kainozoi muộn Việt
13. Phạm Tích Xuân, Nguyễn Hoàng,
2002. Đặc điểm thành phần
thạch học và nguyên tố chính trong bazan Kainozoi muộn
tại Việt
14.
Railsback, 2006.
Some fundamentals of mineralogy and geochemistry. LBR 8150 Point Zero
charge.
15.
Tan Wen-feng et al., 2008. Determination of the PZC of manganese oxides with different
methods including an improved salt titration method. Soil Science, 173/4.
16.
Zobtovitskii Ya.M., 1971. Determination of PZC of metals by the pulsed method. Izv.
Akad. Nauk SSSR, Ser. Khimicheskaya, 7 : 1444-1447. Moskva (in Russian).